Vedecké štúdie - lipozomálne produkty
Lipozomálna technológia
Lipozomálna technológia využíva nanotechnológie vo forme lipozómov, ktorých stavebné bloky, fosfolipidy, sa prirodzene vyskytujú v našich bunkových membránach. Lipozómy sú lipidové vezikuly (vezikula - je názov pre štruktúru vo vnútri alebo mimo bunky a ohraničenú lipidovou 2-vrstvou), do ktorých je možné zapuzdriť aktívne zložky a chrániť ich tak pred nepriaznivým prostredím tráviaceho traktu. Takto sa aktívne zložky prenášajú priamo do krvi.
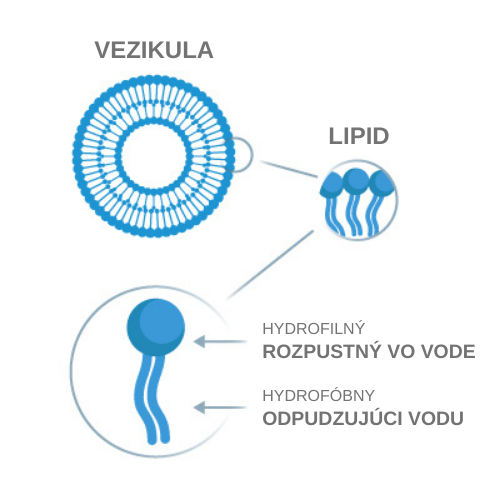
Čo sú to lipozómy?
Slovo lipozóm je odvodené z gréckeho termínu „lipos“ (tuk) a „soma“ (telo).
Lipozómy sú lipidové vezikuly, ktoré sa skladajú z dvoch vrstiev tesne usporiadaných fosfolipidov, tvoriacich dvojitú membránu. Takúto dvojitú membránu nájdeme takmer vo všetkých biomembránach (napr. v bunkových membránach nášho tela). Lipozómy sú schopné transportovať rôzne látky, bez ohľadu na ich náboj, veľkosť alebo štruktúru a zároveň ich chrániť pred tráviacimi enzýmami v tele a do istej miery aj pred žalúdočnou kyselinou. Transport týchto látok môže prebiehať vo vodnom jadre lipozómu, alebo v tukoch rozpustnej dvojitej membráne, v závislosti od toho, či ide o hydrofilnú, alebo hydrofóbnu látku, ktorú lipozóm prepravuje.
Hlavnými stavebnými jednotkami lipozómov sú fosfolipidy. Fosfolipidy sú prevažne rastlinného pôvodu, napr. zo slnečnice. Lipozómy môžu teoreticky splývať aj s bunkovými membránami, pretože štruktúra dvojitej fosfolipidovej membrány je rovnaká ako štruktúra našich hlavných stavebných blokov. Vďaka tejto skutočnosti je absorpcia fosfolipidových membrán a ich príjem v tele prioritou. Takto sa lipozómy ľahko dostanú do cieľa cez tráviaci trakt, nesúc so sebou aktívnu zložku, ktorou môže byť napríklad vitamín C.
Lipozómy majú tri základné vlastnosti:
.png)
Chránia aktívnu zložku: Prostredie žalúdka môže poškodiť niektoré aktívne zložky. Aktívne zložky zapuzdrené v lipozómoch sú v zažívacom systéme chránené.
Maskovanie: Fosfolipidy maskujú aktívne zložky a tak sa môžu absorbovať ich väčšie množstvá. Uniknú tak selektívnej funkcii tenkého čreva. Osmotické (hydrofilné) vedľajšie účinky spôsobené vysokými dávkami niektorých vitamínov a minerálov sa tak dajú znížiť.
Absorpcia: Lipozómy sa prednostne vstrebávajú črevnou stenou, pretože rovnako, ako naše bunkové membrány, pozostávajú z fosfolipidov. Účinné látky potom normálnou absorpciou tukov vstupujú priamo do enterocytov (črevných buniek) a odtiaľ cez lymfatický systém priamo do krvi. Je tak možné sa vyhnúť ceste cez pečeň a zvýšiť tak biologickú dostupnosť aktívnej zložky [*].
Čo znamená "lipozomálny"?
Fosfolipidy sú za určitých podmienok schopné zachytiť kvapalinu v lipidovej bubline. To, či táto kvapalina obsahuje vitamíny, minerály alebo mikroživiny, je pre lipozóm nepodstatné. Počas fázy formovania sú tak esenciálne látky vo vodných roztokoch automaticky uzatvorené v lipozómoch. Potraviny obohatené o lipozómy sa nazývajú „lipozomálne“, ak je primárna účinná látka obsiahnutá v potravine uzavretá v lipozómoch. Zaručený je tak ľahší transport vitamínov, minerálov a mikroživín (aktívnych látok) do krvi cez slizničné a črevné epiteliálne bunky.
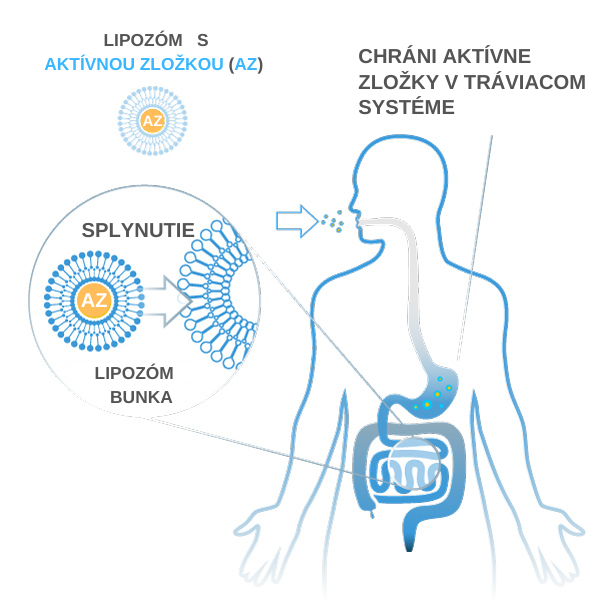
Tento transport aktívnych látok priamo do krvi je možný vďaka tomu, že lipozómy sú amfifilné látky (rozpustné vo vode a v tukoch - časť molekuly je polárna (hydrofilná) a časť molekuly zloženého lipidu je nepolárna (hydrofóbna)). Znamená to takmer úplné dodanie aktívnej látky do krvi. Vďaka tejto optimalizovanej absorpcii je možné významne zvýšiť biologickú dostupnosť a maximalizovať tak účinok aktívnej látky. To má zmysel napríklad vtedy, ak sa užívajú ťažko vstrebateľné účinné látky, ako sú kurkumín, horčík alebo vitamín C, alebo ak sa aktívne látky užívajú vo vysokých dávkach. V prípade bežných výživových doplnkov je pri perorálnom podaní aktívnej látky (užitie napr. kapslí či sirupov ústami) viac ako 75% všetkých aktívnych látok ovplyvnených narušením biologickej dostupnosti, niekedy až tak drasticky, že do krvi sa podarí transportovať iba niekoľko percent aktívnej látky. Pokiaľ teda vitamín, minerál, rastlinná alebo endogénna látka nesie prívlastok „lipozomálny“, znamená to, že bola použitá lipozomálna technológia. Aktívna látka je chránená v dvojitej membráne fosfolipidov a je transportovaná priamo do krvi.
Prečo uprednostniť lipozomálne produkty?
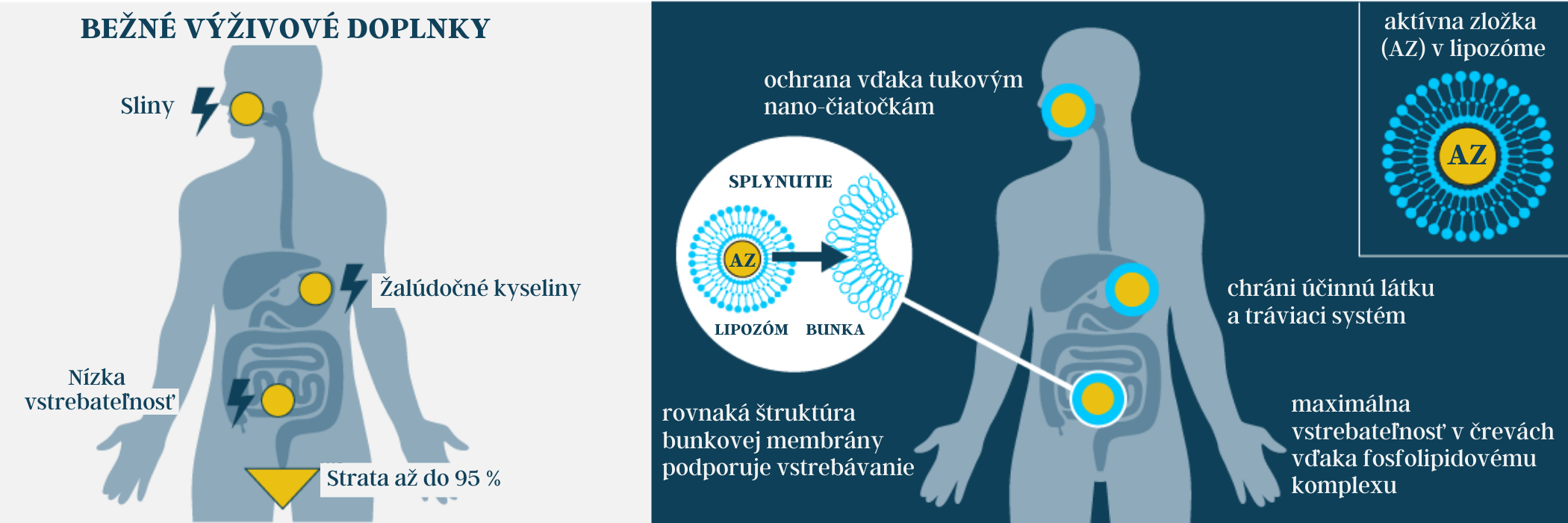
Problém bežných výživových doplnkoch spočíva v ich podstate. Cieľom podania aktívnej látky sú bunky tkanív a tie sú dostupné cez krvný obeh. Teoreticky, intravenózne (aplikovanie do žily – injekcia, alebo infúzia) podávanie aktívnej látky predstavuje najrýchlejší transport na miesto jej účinku. Avšak vďaka tomu, že táto metóda je relatívne komplikovaná a taktiež vďaka oprávnenej obave zo zvýšeného rizika zavedenia infekcie pri aplikácii kanyly (ihly), zvolí sa perorálne podávanie aktívnej látky. Je to v podstate najbežnejšia prax. Perorálne podávané bežné výživové doplnky sú prvou a zatiaľ často jedinou voľbou, pokiaľ ide o prísun dôležitých látok.
Neefektívnosť bežných výživových doplnkov dlhodobo poškodzuje ich reputáciu. Teoretické účinky založené na štúdiách „in vitro“ v mnohých prípadoch kontrastujú s praktickou neúčinnosťou „in vivo“. Niektoré citlivé účinné látky môžu stratiť významnú časť svojich vlastností pri prechode tráviacou sústavou, alebo sa jednoducho neabsorbujú v tenkom čreve. Ak sú molekulárne aglomerácie príliš veľké, majú príliš malú rozpustnosť vo vode na to, aby sa absorbovali, alebo sú príliš hydrofóbne na to, aby sa mohli rozpustiť, môžu iba okrajovo prechádzať cez črevnú stenu a neplnia tak svoju funkciu. Väčšina z nich sa nevyužitá vylúči cez črevo alebo obličky.
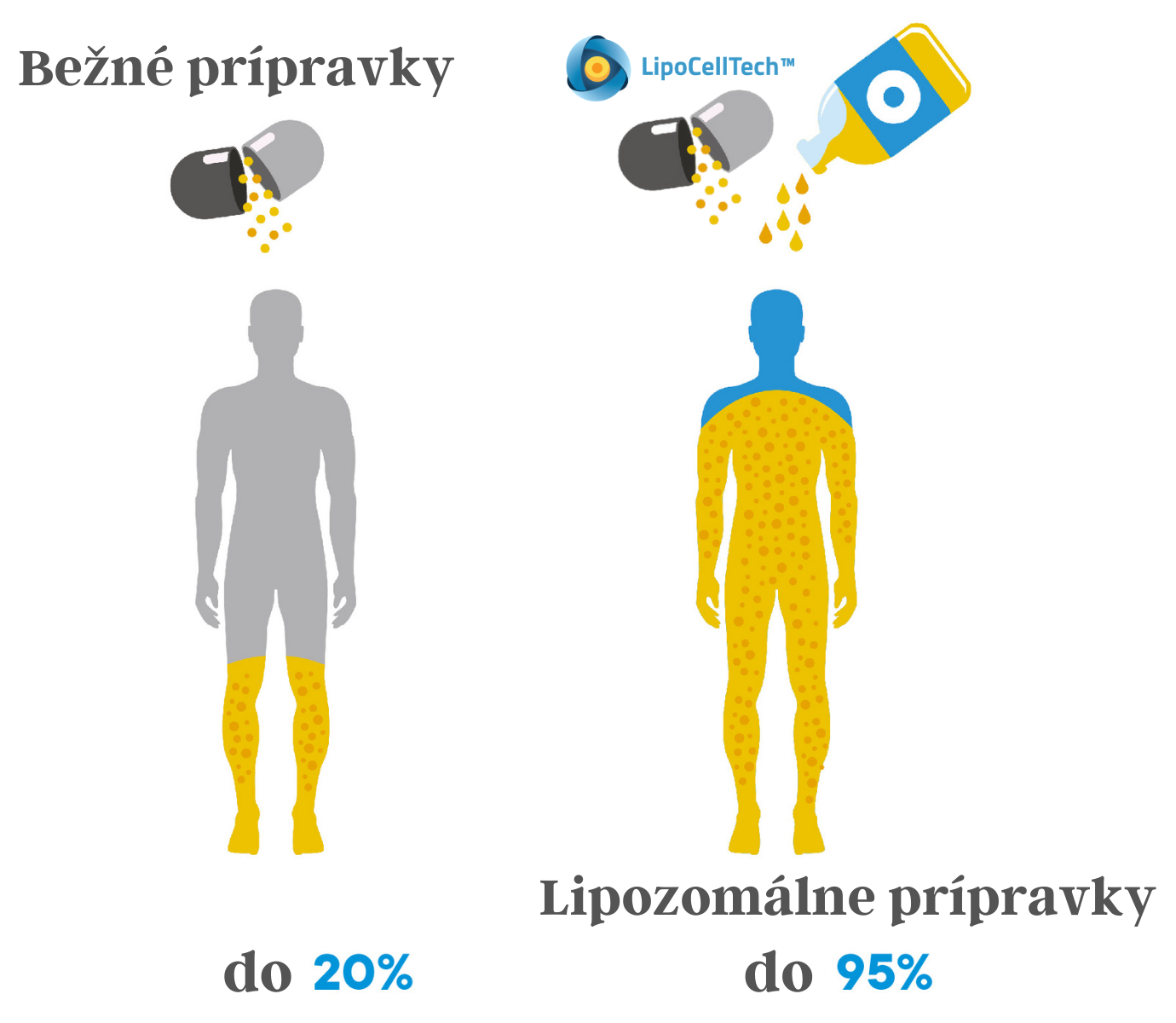
Vedci zistili, že lipozomálne formulácie možno použiť na ochranu a transport terapeutických látok, ako sú lieky, ale aj výživných látok a iných dôležitých zložiek. Lipozómy sa vo farmaceutickom priemysle používajú už desaťročia pod kľúčovým slovom „drug targeting“. Ide o efektívne využitie aktívnej látky vďaka vysokej biologickej dostupnosti a zacieleniu. Štúdie ukazujú, že lipozómy zvyšujú biologickú dostupnosť aktívnej látky až 46,79-krát. To je rýchlosť, akou sa účinná látka dostáva do krvného obehu. Z ekonomického hľadiska možno túto biologickú dostupnosť porovnať s pomerom ceny a výkonu. Čím je biologická dostupnosť účinnej látky vyššia, tým má väčší vplyv na organizmus. Avšak ešte dôležitejšie, ako je pomer cena a výkon je skutočnosť, že veľa aktívnych látok sa vo významnom množstve môže do krvi preniesť len vďaka lipozómom. Pri užívaní bežných výživových doplnkov absorpciu určitého množstvá aktívnej látky nikdy nebolo možné dosiahnu.
Miera vstrebateľnosti lipozomálnych produktov v porovnaní s bežnými výživovými doplnkami
- Gregoriadis, G. [ed.] (2007) Liposome Technology. Third edition. Volume III: Interactions of Liposomes with the Biological Milieu. New York, NY: Informa Healthcare USA, Inc.
- Hickey, S., H. Roberts, and N. Miller. (2008) Pharmacokinetics of oral vitamin C. Journal of Nutritional & Environmental Medicine July 31.
- Hadavi D, Poot AA (2016) Biomaterials for the Treatment of Alzheimer’s Disease; Frontiers in Bioengineering and Biotechnology 4:49
- Hemanthkumar M, Spandana V (2011): Liposomal encapsulation technology a novel drug delivery designed for ayurvedic drug preparation; International Research Journal of Pharmacy 2(10):4-6
- Hoesel, L., M. Flierl, A. Niederbichler, D. Rittirsch, S. McClintock, J. Reuben, M. Pianko, W. Stone, H. Yang, M. Smith, J. Sarma, and P. Ward. (2008) Ability of antioxidant liposomes to prevent acute and progressive pulmonary injury. Antioxidants & Redox Signaling 10(5):973-981.
- Hyeongmin Kim, Yeongseok Kim, Jaehwi Lee (2013): Liposomal formulations for enhanced lymphatic drug delivery, Asian Journal of Pharmaceutical Sciences, Volume 8, Issue 2, Pages 96-103, ISSN 1818-0876
- Imaizumi, S., V. Woolworth, R. Fishman, and P. Chan. (1990) Liposome-entrapped superoxide dismutase reduces cerebral infarction in cerebral ischemia in rats. Stroke 21(9):1312-1317.
- Jiao Z, Wang X, Yin Y, Xia J, Mei Y. (2018) Preparation and evaluation of a chitosan-coated antioxidant liposome containing vitamin C and folic acid. J Microencapsul ;35(3):272-280. doi: 10.1080/02652048.2018.1467509. PMID: 29671362
- Jubeh, T., M. Nadler-Milbauer, Y. Barenholz, and A. Rubinstein. (2006) Local treatment of experimental colitis in the rat by negatively charged liposomes of catalase, T MN and SOD. Journal of Drug Targeting 14(3):155-163.
- Junghans, A., H. Sies, and W. Stahl. (2000) Carotenoid-containing unilamellar liposomes loaded with glutathione: a model to study hydrophobic-hydrophilic antioxidant interaction. Free Radical Research 33(6):801-808.
- Kasbo, J., B. Tuchweber, S. Perwaiz, G. Bouchard, H. Lafont, N. Domingo, F. Chanussot and I. Yousef. (2003) Phosphatidylcholine enriched diet prevents gallstone formation in mice susceptible to cholelithiasis. Journal of Lipid Research 44(12):2297-2303.
- Konno, H., A. Matin, Y. Maruo, 5. Nakamura, and S. Baba. (1996) Liposomal ATP protects the liver from injury during shock. European Surgica/·Research 28(2): 140-145.
- Korb, V., K. Tep, V. Escriou, C. Richard, D. Scherman, L. Cynober, J. Chaumeil, and G. Dumortier. (2008) Current data on ATPcontaining liposomes and potential prospects to enhance cellular energy status for hepatic applications. Critical Reviews in Therapeutic Drug Carrier Systems 25(4):305-345.
- Lamireau, T., G. Bouchard, I. Yousef, H. Clouzeau-Girard, J. Rosenbaum, A. Desmouliere and B. Tuchweber. (2007) Dietary lecithin protects against cholestatic liver disease in cholic acid-fed Abcb4- deficient mice. Pediatric Research 61(2):185-190.
- Lee, S., H. Yuk, D. Lee, K. Lee, Y. Hwang and R. Ludescher. (2002) Stabilization of retinal through incorporation into liposomes. Journal of Biochemistry and Molecular Biology 35(4) :358-363.
- Lee, S., Y. Han, B. Min, and I. Park. (2003) Cytoprotective effects of polyenoylphosphatidylcholine (PPC) on beta-cells during diabetic induction by streptozotocin. The Journal of Histochemistry and Cy tochemistry 51(8):1005-1015.
- Levy, T. (2006) Stop America’s #1 Killer. Reversible Vitamin Deficiency Found to be Origin of ALL Coronary Heart Disease. Henderson, NV: LivOn Books.
- Liang, W., D. Johnson, and S. Jarvis. (2001) Vitamin C transport systems of mammalian cells. Molecular Membrane Biology 18(1):87-95.
- Lieber, C. (2004) Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis. Alcohol 34(1):9-19.
- Ling, S., E. Magosso, N. Khan, K. Yuen, and S. Barker. (2006) Enhanced oral bioavailability and intestinal lymphatic transport of a hydrophilic drug using liposomes. Drug Development and Industrial Pharmacy 32(3):335-345.
- Lubin, B., S. Shohet, and D. Nathan. (7972) Changes in fatty acid metabolism after erythrocyte peroxidation: stimulation of a membrane repair process. The Journal of Clinical Investigation 51(2):338-344.
- Maheshwari, H., R. Agarwal, C. Patil and O.Katare. (2003) Preparation and pharmacological evaluation of silibinin liposomes. ArzneimitteIforschung 53(6) :420 – 427.
- Mandal, A., S. Das, M. Basu, R. Chakrabarti and N. Das. (2007) Hepatoprotective activity of liposomal flavonoid against arsenite-induced liver fibrosis. The Journal of Pharmacology and Experimental Therapeutics 320(3):994-1001.
- Mastellone, I., E. Polichetti, S. Gres, C. de la Maisonneuve, N. Domingo, V. Marin, A. Lorec, C. Farnarier, H. Portugal, G. Kaplanski, F. Chanussot. (2000) Dietary soybean phosphatidylcholines Iower lipidemia: mechanisms at the levels of intestine, endothelial cell, and hepato-biliary axis. The Journal of Nutritional Biochemistry 77(9) :467- 466.
- Meister, A. (1994) Glutathione-ascorbic acid antioxidant system in animals. The Journal of Biological Chemistry 269(13):9397-9400.
- N., M. Babaei, A, Vali, F. Daha, F. Kobarfard, and S. Dadashzadeh. (2008) 99mTc-HMPAO-labeled liposomes: an investigation into the effects of some formulation factors on labeling efficiency and in vitro stability. Nuclear Medicine and Biology 35(3):387-392,
- Misra A1, Jinturkar K, Patel D, Lalani J, Chougule M. (2009) Recent advances in liposomal dry powder formulations: preparation and evaluation. Expert Opin Drug Deliv; 6(1):71-89. doi: 10.1517/17425240802652309 .
- Nakae, D., K. Yamamoto, H. Yoshiji, T. Kinugasa, H. Maruyama, J. Farber and Y. Konishi. (1990) Liposome-encapsulated superoxide dismutase prevents liver necrosis induced by acetaminophen. American Journal of PathoIogy 136(4) :7 87 -7 95.
- Pintea, A., H. Diehl, C. Momeu, L. Aberle and C. Socaciu, (2005) Incorporation of carotenoid esters into liposomes. Biophysical Chemistry 778(l) :7 -74.
- Puisieux, F., E. Fattal, M. Lahiani, J. Auger, P. Jouannet, P. Couvreur and J. Delattre. (1994) Liposomes, an interesting tool to deliver a bioenergetic substrate (ATP). In vitro and in vivo studies. Journal of Drug Targeting 2(5):443-448.
- Puskas, F., P. Gergely, Jr., K. Banki, and A. Perl. (2000) Stimulation of the pentose phosphate pathway and glutathione levels by dehydroascorbate, the oxldized form of vitamin C. The FASEB Journal 14(10): 1352-1361.
- Rawat, A., B. Vaidya, K. Khatri, A, Goyal, P. Gupta, S. Mahor, R. Paliwal, S. Rai, and S. Vyas. (2007) Targeted intracellular delivery of therapeutics: an overview. Die Pharmazie 62(9):6a3-658.
- Rosenblat, M., N. Volkova, R. Coleman, and M. Aviram. (2007) Antioxidant and anti-atherogenic properties of liposomal glutathione: studies in vitro, and in the atherosclerotic apolipoprotein E-deficient mice. Atherosclerosis 195(2):e61-e68.
- Sarkar, S. and N. Das. (2006) Mannosylated liposomal flavonoid in combating age-related ischemia-reperfusion induced oxidative damage in rat brain. Mechanisms of Ageing and Development 727(4):391-397.
- Sato, Y., K. Murase, J. Kato, M. Kobune, T. Sato, Y. Kawano, R. Takimoto, K. Takada, K. Miyanishi, T. Matsunaga, T.Takayama and Y. Niitsu. (2008) Resolution of liver cirrhosis using vitamin A-coupled liposomes to deliver siRNA against a collagen-specific chaperone. Nature Biotechnology 26(4):431-442.
- Schnyder, A. and l. Huwyler. (2005) Drug transport to brain with targeted liposomes. NeuroRx: The lournal of the American Society for Experimental NeuroTherapeutics 2(L):99-707.
- Sinha J, Das N, Basu MK (2001): Liposomal antioxidants in combating ischemia-reperfusion injury in rat brain; Biomedicine and Pharmacotherapy 55(5):264-271
- Sinha R, Sinha I, Calcagnotto A, Trushin N, Haley JS, Schell TD, Richie JP Jr. (2018) Oral supplementation with liposomal glutathione elevates body stores of glutathione and markers of immune function. Eur J Clin Nutr ;72(1):105-111. doi: 10.1038/ejcn.2017.132. Epub 2017 Aug 30. PMID: 28853742
- Socaciu, C., P. Bojarski, L. Aberle, and H. Diehl. (2002) Different ways to insert carotenoids into liposomes affect structure and dynamics of the bilayer differently. Biophysical Chemistry 99(1):1-15.
- Verma, D., T. Levchenko, E. Bernstein, and V. Torchilin. (2005) ATPloaded liposomes effectively protect mechanical functions of the myocardium from global ischemia in an isolated rat heart model. Journal of Controlled Release 108(2-3):460-477.
- Verma, D., W, Hartner, V. Thakkar, T. Levchenko and V. Torchilin. (2007) Protective effect of coenzyme Q10-loaded liposomes on the myocardium in rabbits with an acute experimental myocardial infarction. Pharmaceutical Research 24(17) :273t-2737.
- Walde, P., A. Giuliani, C. Boicelli, and P. Luisi. (1990) Phospholipidbased reverse micelles. Chemistry and Physics of Lipids 53(4):265-28B.
- Walde, P. and S. Ichikawa. (2001) Enzymes inside lipid vesicles: preparation, reactivity and applications. Biomolecular Engineering t8(4):743-177.
- Waters, R., L. White, and J. May, (1997) Liposomes containing alpha tocopherol and ascorbate are protected from an external oxidant stress. Free Radical Research 26(4):373-379.
- Wendel, A. (1983) Hepatic lipid peroxidation: caused by acute drug intoxication, prevented by liposomal glutathione. International Journal of Clinical Pharmacology Research 3(6):443-447.
- Wilson, J. (2005) Regulation of vitamin C transport. Annual Review of Nutrition 25:105-125.
- Wu, J. and M. Zern. (1999) NF-kappa B, liposomes and pathogenesis of hepatic injury and fibrosis. Frontiers in Bioscience 4:D520-D527.
- Xi, J. and R. Guo. (2007) Interactions between flavonoids and haemoglobin in lecithin liposomes. International Journal of Biological Macromolecules 40(4):305-31 1.
- Yamada, Y. and H. Harashima. (2008) Mitochondrial drug delivery systems for macromolecule and their therapeutic application to mitochondrial diseases. Advanced Drug Delivery Reviews 60(13-14):1439-1462.
- Yao, T., S. Esposti, L. Huang, R. Arnon, A. Spangenberger, and M. Zern. (1994) Inhibition of carbon tetrachloride-induced liver injury by liposomes containing vitamin E. The American Journal of Physiology 267(3 Pt1):G476-G484.
- Yoshimoto, M., Y. Miyazaki, Y. Kudo, K. Fukunaga and K. Nakao. (2006) Glucose oxidation catalysed by liposomal glucose oxidase in the presence of catalase-containing liposomes. Biotechnology Progress 22(3):704-709.
.png)